Wie Blutzellen wachsen

Im Institut für Physik bezeugt ein raumfüllender, komplexer Versuchsaufbau aus allerlei Optiken, Spiegeln und Lasereinheit die langjährige Forschungsarbeit der Wissenschaftler. Wie Prof. Dr. Jan Laufer erklärt, ist der hier genutzte photoakustische Effekt als bildgebendes Verfahren für die Biomedizin erst seit Mitte der 90er Jahre ein aktives Forschungsthema. „Die Photoakustik an sich ist aber ein relativ altes Fachgebiet und bekannt von ihrer Anwendung bei den Materialwissenschaften, etwa zur Materialprüfung durch laserinduzierten Ultraschall. Damit kann man beispielsweise in Metallen mögliche Risse nachweisen“, erklärt der 47-Jährige. Immer mehr wird jedoch der photoakustische Effekt als bildgebendes Verfahren in der Medizin und Biologie genutzt.
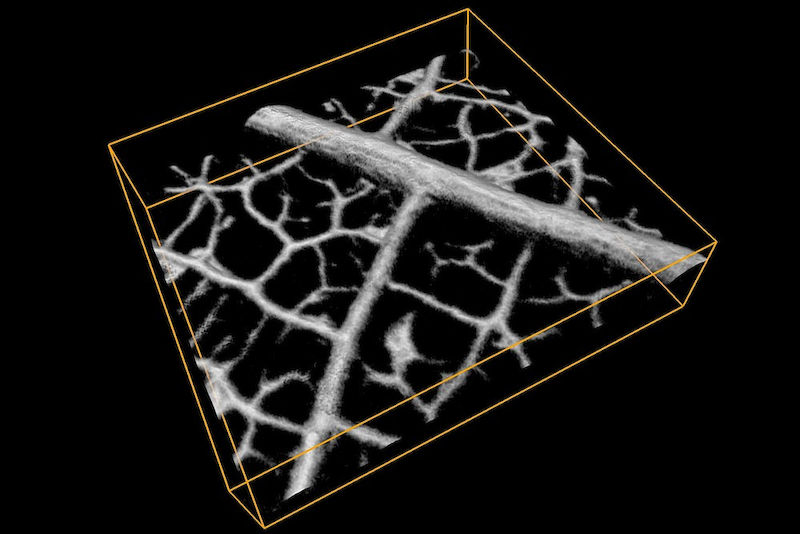
Das seit 2017 in Halle ansässige von der Deutschen Forschungsgemeinschaft (DFG) geförderte Projekt, das den Titel „Dynamisch fokussierte photoakustische Mikroskopie der Angiogenese in vivo“ trägt und in Kooperation mit dem Berliner Max-Delbrück-Centrum für Molekulare Medizin (MDC) läuft, verfolgt dabei ein ehrgeiziges Ziel. Mittels photoakustischer Mikroskopie sollen hochauflösende Bilder speziell von Blutgefäßnetzwerken dargestellt werden – dazu in Echtzeit. „Bildlich gesprochen wollen wir das vaskuläre System genau unter die Lupe nehmen und schauen, unter welchen Bedingungen sich Blutgefäße bilden. Das Hauptaugenmerk der Forschung liegt dabei auf den Parametern, die das Gefäßwachstum begünstigen“, betont Jan Laufer, der 2017 von der Technischen Universität Berlin an die MLU kam. Einer dieser Parameter ist die Sauerstoffsättigung im Blut. „Hier will man mikroskopisch ermitteln, wieviel Sauerstoff die roten Blutzellen in sich tragen und wie stark der Durchfluss dieser Zellen durch ein bestimmtes Gefäß ist. Anhand dieser Erkenntnisse kann man später ableiten, welche Umstände sich begünstigend oder hemmend auf die Aussprossung von Blutgefäßen auswirken“, so der Forscher.
Neue Erkenntnisse für die Tumorforschung
Warum diese Erkenntnisse über Gefäßbildungen aus medizinischer Sicht so wichtig sind, kann Ulrike Pohle schnell begründen. „Vielversprechende Ansatzpunkte gibt es hier für die Tumorbiologie und Krebsforschung, man denke nur an das Tumorwachstum. Tumoren sind nährstoffhungrige Gewebe. Und zur Versorgung brauchen sie ein starkes Gefäßnetzwerk, was sich erst auf Befehl des Tumors ausbildet. Bislang kann man noch nicht hinreichend nachvollziehen, was da im Körper passiert“, erklärt die Doktorandin. Hilfreich wären deshalb Erkenntnisse, wie man das Wachstum der am Tumor angebundenen Gefäße hemmen oder gar unterbinden könne. Aber auch die normale Gefäßbildung steht im Focus. „Etwa, wenn es um Verletzungen und Heilungsprozesse geht.“ Ganz egal ob Schnitt-, Platz-, Schürf- oder Brandwunde: Künftig könnte der vaskuläre Heilungsprozess beschleunigt werden, wenn man die Faktoren kennt, die für eine schnelle Regenerierung sorgen.
Doch wie kann man sich das Ganze vorstellen? „Der photoakustische Effekt beruht im Grunde auf der Erzeugung akustischer Wellen, die durch die Bestrahlung eines Objektes mit kurzen Lichtimpulsen entstehen“, erklärt Laufer. Treffen diese Lichtimpulse beispielsweise aufs Gewebe, so wird die optische Energie sehr schnell in Wärme umgewandelt. Und diese Wärme erzeuge wiederum – wenn der Impuls sehr kurz war – prompt einen Druck, durch den eine Schallwelle ausgesendet wird. Ab hier, wo der Schall ins Spiel kommt, gleicht das weitere Verfahren dem Ultraschall, dem allseits bekannten Klassiker der medizinischen Bildgebung.
Zunutze machen sich nun die Wissenschaftler eine hilfreiche physikalische Eigenschaft der Photoakustik. Denn die Lichtimpulse werden je nach Gewebeart und den dort enthaltenen Farbstoffen verschiedentlich adsorbiert. Das heißt: Gefäße, Muskeln oder Tumorgewebe – sie alle verraten sich durch unterschiedliche Ultraschallwellen, die anschließend über Sensoren an der Gewebeoberfläche „abgehört“ und zu einem Bild zusammengeführt werden. Dank spezieller Rechenalgorithmen lassen sich daraus 3D-Bilder rekonstruieren. Die ersten Probeläufe haben die halleschen Physiker mit einem Blattskelett und einer Zebrafischlarve durchgeführt.
Physikalische Grenzen sind noch nicht erreicht
Das neue Mikroskop der halleschen Medizinphysiker erfüllt bislang alle Erwartungen. „Ein normales Bild entsteht schon recht schnell, ein dreidimensionales wird in wenigen Sekunden ausgegeben. Und doch ist das für die Anwendung, die aus Bildfolgen bestehen soll, nicht schnell genug. Wir arbeiten daran, ein so genanntes Fast-Scanning zu implementieren, um dann wirklich mit einer hohen Bildrate arbeiten zu können“, sagt Ulrike Pohle. „Erst dann wird es möglich sein, vaskuläre Prozesse wie den Blutfluss in Kapillargefäßen in Echtzeit zu verfolgen.“
Die Wissenschaftler aus Halle und Berlin blicken bereits auf eine erfolgreiche zweijährige Kooperation zurück. Gerade in der Anfangsphase gab es eine sehr intensive Zusammenarbeit bei der Entwicklung. „Mit jetzigem Stand konnten wir das Gerät duplizieren, so dass am Max-Delbrück-Centrum und hier im Physikinstitut je eine Version steht“, berichtet Laufer. Während sich die Berliner Kollegen, allen voran Prof. Dr. Holger Gerhardt von der Forschungsgruppe integrative vaskuläre Biologie, mit der Methodenentwicklung beschäftigen, sind die halleschen Physiker dabei, die Technologie weiter zu verbessern. Vor allem der Detektor des Mikroskops ist ein Novum. „Ist es sonst üblich, die Ultraschall-Signale mittels piezoelektrischen Ultraschallwandlern zu detektieren, nutzen wir hierfür einen optischen Ultraschallsensor. Ein großer Vorteil ist, dass wir diesen Sensor ganz nah ans Gewebe bringen können und dadurch auch eine höhere Empfindlichkeit erreichen. Wird die Schallwelle besser abgegriffen, ist natürlich auch die Bildinformation genauer“, sagt Laufer und fügt hinzu, dass die Möglichkeiten längst noch nicht ausgeschöpft sind.
So gibt es bereits Ideen, mit denen man künftig die Leistungsfähigkeit, etwa der räumlichen Auflösung oder Tiefenempfindlichkeit des Mikroskops, weiter erhöhen kann. „Mit der jetzigen Technologie können wir schon fast einen Millimeter tief ins Gewebe eindringen. Das Ende der Fahnenstange ist damit aber noch nicht erreicht. Wir wollen künftig noch ein bisschen tiefer ins Gewebe schauen“, kündigt Laufer an.